La tuberculosis (TBC) sigue siendo una de las 10 causas principales de mortalidad en el mundo. En 2016, 10.4 millones de personas enfermaron de TBC y 1.7 millones murieron por esta enfermedad, entre ellos 0.4 millones de personas con VIH porque en estos se incrementa la susceptibilidad de sufrir TBC hasta en 100 a 200 veces.1,2 La TBC multirresistente (MDR TB, por sus siglas en inglés) constituye una crisis de salud pública y una amenaza para la seguridad sanitaria. Más del 95% de las muertes por TBC se producen en países con bajos y medianos ingresos. Por su fuerte asociación con la pobreza y el hacinamiento, es una enfermedad que nunca ha sido erradicada en países subdesarrollados.3,4 Acabar para 2035 con la epidemia de TBC es una de las metas de salud incluidas en los objetivos de desarrollo sostenible adoptados por la Organización Mundial de la Salud (OMS) en 2015. En México, las instituciones de salud de los 32 estados, en 2017 reportaron 3,927 casos nuevos de TBC respiratoria, y 820 casos de TBC en otras formas, incluyendo TBC del sistema nervioso, de otros órganos y miliar.
En el 80% de los casos de infección por Mycobacterium tuberculosis existe afectación pulmonar; sin embargo, hasta en el 20% de los casos puede haber compromiso extrapulmonar. En la región de cabeza y cuello se puede presentar hasta en 10% de todos los casos de TBC, en donde los ganglios linfáticos cervicales son los más comúnmente involucrados; por otra parte, se identificó TBC nasofaríngea (NPTB, por sus siglas en inglés) en menos del 1% en la categoría de TBC de cabeza y cuello.3,5-7
Se estima que aproximadamente el 33% de la población mundial se encuentra colonizada por Mycobacterium tuberculosis, pero de estas personas solo el 5 a 10% desarrollarán signos y síntomas de la enfermedad. La OMS considera que factores como el insuficiente personal de salud entrenado y limitaciones del personal de laboratorio clínico, son los responsables del mal diagnóstico y manejo inadecuado de los pacientes con TBC. Dado que la transmisión de esta enfermedad se produce principalmente por vía aérea, las prácticas clínicas de los estudiantes del área de la salud son entornos de alto riesgo para la transmisión de TB.8,9
El objetivo de esta revisión es demostrar la importancia de identificar a los pacientes con TBC activa o en riesgo de padecerla, a propósito del aumento de casos nuevos, y porque muchos estudiantes de estomatología y egresados no tienen los suficientes conocimientos sobre las manifestaciones clínicas y de los métodos de prevención de la transmisión; además de brindar información actualizada acerca de la enfermedad como foco de infección cruzada.6,7,10
Manifestaciones clínicas
Se calcula que una tercera parte de la población mundial tiene TBC latente, es decir, las personas están infectadas por el bacilo tuberculoso, aunque aún no se han enfermado y no pueden transmitir la infección, pero el 10% de ellas tienen riesgo de enfermar de TBC a lo largo de la vida.11,12
La TBC es una enfermedad cuyas manifestaciones clínicas no permiten diferenciarla con facilidad de otras entidades parecidas. La mayoría de los casos son de inicio insidioso, poco alarmante y bastante variable, dependiendo de la virulencia del agente causal, la edad, el órgano afectado y el estado inmunitario del huésped. Los síntomas llegan a incluir: fiebre, pérdida de apetito y peso, astenia, sudoración nocturna profusa y malestar general. En ocasiones aparece palidez y acropatías. Pueden oírse roncus originados por la obstrucción parcial de los bronquios y un timbre metálico al auscultar la cavidad pulmonar y encontrar biometría hemática con anemia ligera y leucocitosis.
La sintomatología puede ser leve y durar muchos meses; por tal motivo, los pacientes tardan en buscar atención médica y, en consecuencia, transmiten la bacteria a otras personas. A lo largo de un año, un paciente con TBC puede infectar de 10 a 15 personas por contacto cercano.4,13
Los sitios más comunes de TBC extrapulmonar en la región de cabeza y cuello son los ganglios linfáticos cervicales (81.25%), seguidos de la región sinonasal (6.2%), cavidad oral (4.1%), larínge, región retrofaríngea y espacio bucal, mientras que la TBC cutánea de la región de cabeza y cuello únicamente representa el 2.05%.14,15
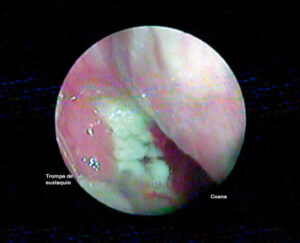
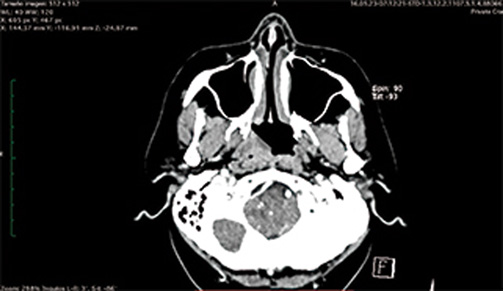
Las linfadenopatías pueden ser múltiples, usualmente unilaterales, con mayor frecuencia en las cadenas ganglionares profundas, con un tamaño de 1.5 a cinco centímetros, las cuales generalmente se acompañan de adenopatías en distintas localizaciones como la región supraclavicular y axilar. Otras áreas que suelen afectarse concomitantemente son la faringolaringe, anillo de Waldeyer, oídos y apófisis mastoides, nariz, nasofaringe y senos paranasales, glándulas salivales o en piel y mucosas, donde llega a manifestarse como lesiones ulcerativas, granulomatosas, polipoides, múltiples o lesiones aisladas.10,16
Tuberculosis oral
La TBC oral es una manifestación poco usual de la TBC extrapulmonar. Puede ser primaria o secundaria; la primaria es rara y más frecuentemente encontrada en niños y adolescentes; en tanto que la forma secundaria es más común (0.005 a 1.5% de los casos) y se ve generalmente en pacientes de mediana edad y ancianos.9,14 Se presenta en cualquier sitio de la cavidad oral y estructuras asociadas como mandíbula (hueso alveolar y basal), ganglios linfáticos de cara y cuello, glándulas salivales, antro y hueso maxilar, tejidos blandos como encía, lengua, músculos de la masticación, mucosa bucal, articulación temporomandibular o labios.17 Las úlceras son las manifestaciones orales más habituales de TBC en cavidad oral; en una TBC primaria producida por inoculación directa de una persona infectada a una susceptible, puede aparecer una úlcera asintomática y localizada, vinculada a la presencia de linfadenomegalia. Las ulceraciones en la TBC secundaria, originadas por autoinoculación a partir de secreciones contaminadas con el bacilo, causan profundo dolor. Los cambios dolorosos pueden interferir con el habla y la ingestión de alimentos, así como de ocasionar hiposalivación.16,17
Dolor y odinofagia son los síntomas locales más comunes y representan el 15% de todos los casos, acompañados de disfonía; otros síntomas incluyen sensación ardorosa, reflujo, salivación excesiva, halitosis y hemorragia intraoral. Los síntomas cutáneos incluyen una erupción escamosa en cabeza, eritema nodoso y lesiones en cuello, muñeca y cuerpo.14,18
Las úlceras en la cavidad oral son usualmente únicas, o en ocasiones son múltiples. La base de la úlcera puede estar cubierta de corpúsculos amarillentos o azulados, denominados gránulos de Trélat. Las ulceraciones tuberculosas duran mucho tiempo y no muestran tendencia a sanar y aumentan lentamente de tamaño.
Factores predisponentes y patofisiología
En la cavidad oral la mucosa oral intacta, el flujo constante de saliva y su acción antibacteriana protegen de la invasión de bacilos tuberculosos a los tejidos subyacentes. Aunque el mecanismo de la inoculación primaria no se ha establecido definitivamente, se sabe que proviene del contacto de alguna secreción de una persona infectada, ya sea de manera directa o a través de un objeto o instrumental contaminado, al tiempo que en la lesión secundaria parece que los microorganismos son transportados en el esputo y entran en la mucosa oral como resultado de irritación crónica o inflamación, así que cualquier trauma local puede promover la infección. Otros factores locales predisponentes incluyen pobre higiene oral, ulceras, inflamación de la mucosa oral incluso después de una extracción dental, fractura de mandíbula, quistes o abscesos.9,16,17 Es imperativo realizar una adecuada inspección, dado que las lesiones orales por TBC pueden ocurrir en cualquier zona propensa a inoculación, aun por debajo de prótesis.
Diagnóstico
Cuando se sospecha de TBC en cabeza y cuello, el diagnóstico se hará sobre la base de una historia clínica cuidadosa. Es importante tener en cuenta la sintomatología para diferenciar la TBC oral de otras entidades infectocontagiosas que cursen con signos como fiebre, linfadenomegalias, cambios cutáneos, trastornos gastrointestinales, tos crónica y malestar general.2,6,16
El diagnóstico de TBC con frecuencia se retrasa y puede ser un hallazgo inesperado por la escasa frecuencia de afectación en cabeza y cuello, la poca especificidad de muchas de sus manifestaciones y la baja disponibilidad de pruebas rápidas.19 La TBC de cabeza y cuello con afectación pulmonar simultánea tiene lugar en un 10-20% de los casos y su diagnóstico debe estar respaldado por estudios de imagen y baciloscopia seriada para orientar el diagnóstico. No es infrecuente que casos de TBC de cabeza y cuello se diagnostiquen inicialmente como cáncer, puesto que en ocasiones pueden coexistir ulceras bucales con afección pulmonar y simular algún carcinoma con metástasis.20
Para un diagnóstico de certeza y rápido se requiere siempre la detección de M. tuberculosis con la tinción para detectar bacilos acido-alcohol resistente (BAAR) mediante el empleo de las técnicas de Ziehl Neelsen y Auramina, pero para que sean detectables deben existir entre 5,000-10,000 bacilos/ml en la muestra, lo cual no es probable en la TBC nasofaríngea, en la que las lesiones más frecuentes son granulomatosas o nodulares.19,20 Es por ello que en las presentaciones de TBC extrapulmonares se recomiendan muestras obtenidas de tejidos por biopsia y su cultivo microbiológico con una sensibilidad entre el 70-80%, porque en muestras de líquidos biológicos es del 5-20%.13,21
Diagnóstico diferencial
El cuadro clínico de TBC es variable y no específico, por lo que el diagnóstico diferencial incluye varias enfermedades granulomatosas (cuadro 1). Para determinar la causa de la ulceración oral se requiere un historial médico completo, examen clínico y exámenes de laboratorio e imagen complementarios. Es esencial definir el número de úlceras, su duración y apariencia de los márgenes.16,22
Tratamiento
Los fármacos antituberculosos se han usado por decenios y la resistencia a ellos va en aumento. En todos los países estudiados se ha comprobado la existencia de cepas del bacilo que presentan resistencia a por lo menos un medicamento antituberculoso. En algunos casos la farmacorresistencia puede ser severa y se conoce como TBC ultrarresistente.1,2 En 2010 se contabilizaron cerca de 650,000 enfermos de TBC farmacorresistente en el mundo y se calcula que 9% de estos eran del tipo ultrarresistente.23
En cuanto a la farmacoterapia, se recomienda un esquema de cuatro medicamentos (isoniazida, pirazinamida, ethambutol, rifampicina) durante la primera fase de tratamiento, para asegurar su eficacia, y de acuerdo con el esquema seleccionado pueden administrarse diariamente o tres veces por semana durante dos meses. En la segunda fase del tratamiento se realiza con al menos dos medicamentos hasta completar seis meses.2,8
La vacuna BCG es el procedimiento preventivo universal contra la TBC. La declaración de principios de la Federación Dental Internacional incita a que los profesionales responsables de la salud bucodental tomen conocimiento de esta enfermedad pandémica, además de que por norma deben recibir la vacunación BCG, sobre todo en regiones geográficas o ambientes sanitarios donde la TBC está muy extendida.8,23
La OMS sugiere que el tratamiento debe ser directamente supervisado para asegurar la adherencia al mismo, y así permitir identificar aquellos pacientes con riesgo de abandono al tratamiento y a quienes desarrollan efectos secundarios a los fármacos antifímicos. Es importante vigilar que el paciente tome diariamente sus medicamentos, porque debido a las reacciones secundarias indeseables, o a que el paciente se siente mejor, a menudo abandona la terapia. En los pacientes con VIH quizás sea necesario extender el periodo de administración.9,23,24 El manejo supervisado verificando la ingesta de los medicamentos logra una tasa elevada de curación.2,3
Prevención de la transmisión
Las enfermedades infecciosas representan un serio riesgo para los profesionales de la salud. La magnitud de riesgo de transmisión de TBC a un trabajador varía de acuerdo a la incidencia de TBC activa en la comunidad, el tipo de clínica donde trabaja y sus condiciones socioambientales.1,5 La categoría de riesgo para los consultorios dentales puede ser de: Riesgo mínimo: no se han tratado pacientes con TBC activa, y no se han reportado casos en la comunidad en el último año; Muy bajo riesgo: no se han tratado pacientes con TBC activa, pero se han reportado casos en la comunidad en los últimos doce meses; Bajo riesgo: se ha dado tratamiento dental a menos de seis pacientes con TBC activa en un año y no hay evidencia de transmisión de la enfermedad; Riesgo intermedio: se ha dado tratamiento dental a seis o más pacientes con TBC activa en un año; Alto riesgo: hay evidencia de transmisión de TBC.1,3,5
Es muy importante considerar que, tanto en áreas clínicas como las salas de espera, las posibilidades de infección pueden ser altas porque el aislamiento y el tratamiento no se han implementado debido a que los pacientes aún no han sido valorados ni diagnosticados.23
La TBC se transmite a través de la vía aérea cuando el paciente con TBC pulmonar activa habla, estornuda o tose, pues las partículas con el bacilo son aerolizadas en el ambiente y dichas gotas llegan a permanecer circulando en el aire por largos periodos de tiempo, así que cualquier persona puede infectarse al inhalar las partículas,23,25 y por ello el riesgo de infección se basa no solo en las probabilidades de estar en contacto con el bacilo, sino también en el nivel de comprensión y aplicación de adecuadas medidas de protección.
El personal de odontología que trabaje en centros hospitalarios, casas de retiro, centros penales, comunidades con bajos recursos, malas condiciones de sanidad o correccionales, tiene mayor riesgo de contraer TBC que el personal que labora en clínicas privadas, porque las características socioambientales y demográficas de la población atendida pueden contribuir a la transmisión de TBC.3
Las medidas preventivas incluyen desde evitar la generación de micropartículas, impedir su diseminación, reducir la contaminación del aire (adecuada ventilación ambiental y el empleo de ventiladores y/extractores o purificadores de aire), así como de las precauciones universales de bioseguridad.26