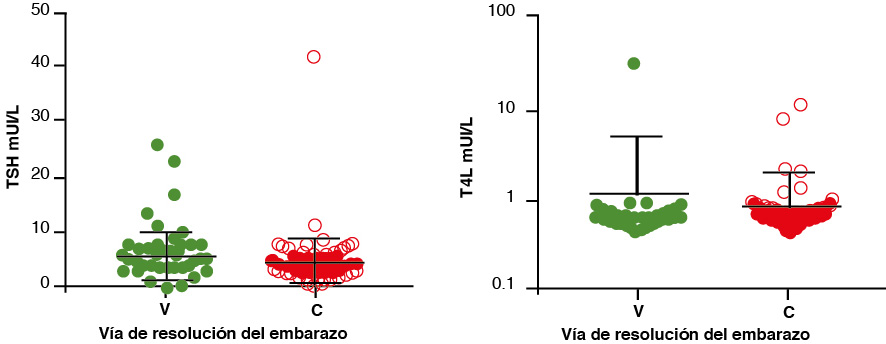
El análisis de normalidad para los grupos V y C, tanto para la concentración de la TSH como para la de T4L, demostró que no se comportaron como poblaciones normales (p < 0.0001). La figura 2 muestra que las pruebas de Mann-Whitney no tuvieron diferencia estadísticamente significativa para las concentraciones de TSH o T4L en las mujeres embarazadas con hipotiroidismo subclínico y que resolvieron el embarazo por vía V o por C.
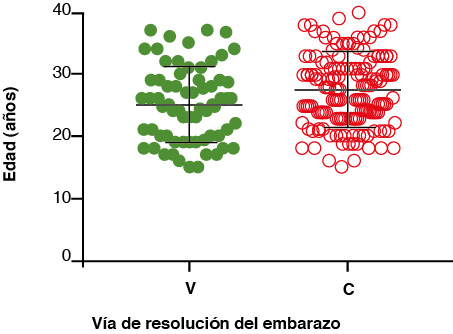
El cuadro 2 evidencia que las mujeres embarazadas con hipotiroidismo subclínico que resolvieron el embarazo por vía V o por C fueron diagnosticadas con similar frecuencia en los diferentes trimestres de embarazo. También muestra que 34 de las 67 pacientes del grupo V (50.7%) fueron primigestas, en tanto que 40 de 121 en el grupo C (33%) fueron primigestas, con una diferencia estadísticamente significativa con la prueba Chi-cuadrada p = 0.017. Trece de las 67 pacientes en el grupo V (19.4%) tuvieron antecedente de abortos previos, mientras que 44 de las 121 pacientes en el grupo C (36.3%) tuvieron antecedente de abortos previos, con una diferencia estadísticamente significativa con la prueba de Chi-cuadrada, p = 0.015. Finalmente, sí se encontró una mayor frecuencia de casos de preeclampsia en el grupo de mujeres embarazadas con hipotiroidismo subclínico tratadas y que resolvieron el parto por vía C (p = 0.034, Fisher exact test).
Solo 59 de 67 pacientes en el grupo V (88%) recibieron tratamiento, y 95 de 121 en el grupo C (78.5%). En la figura 3 se advierte que no hubo diferencia estadísticamente significativa para la dosis inicial de levotiroxina en las mujeres embarazadas con hipotiroidismo subclínico y que resolvieron el embarazo por vía V o por C. El análisis de normalidad para los grupos V y C puso de manifiesto que se comportaron como poblaciones normales (p = 0.573 y p = 0. 349, respectivamente). La prueba de T no pareada no mostró diferencia significativa entre los grupos (p = 0.263).
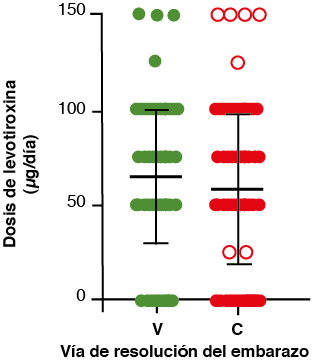
Figura 3. Dosis inicial de Levotiroxina en pacientes embarazadas e hipotiroidismo subclínico clasificadas por vía de resolución de parto. Dosis de levotiroxina en mg/día.
V: parto vaginal; C: parto por cesárea.
Media ± SD. D’Agostino normality test: p = 0.292 y p = 0.775 para V y C, respectivamente. T student test, p = 0.263.
En el cuadro 3 se aprecia que la frecuencia de recién nacidos masculinos y femeninos fue similar en ambos grupos de pacientes (p = 0.172). Asimismo, se observó que hay diferencia estadísticamente significativa para la edad gestacional de recién nacidos de mujeres embarazadas con hipotiroidismo subclínico y que resolvieron el embarazo por vía V o por C, siendo la edad gestacional menor en el grupo de nacimiento por vía C que por vía V (p = 0.015, prueba U de Mann-Whitney). Igualmente se advierte diferencia estadísticamente significativa en la talla al nacer entre ambos grupos, siendo menor en recién nacidos por vía C que por vía V (p = 0.036, con la prueba U de Mann-Whitney). Finalmente, no se halló diferencia estadísticamente significativa en el peso de los recién nacidos o la frecuencia de Apgar bajo o Silverman alto entre los recién nacidos de mujeres con hipotiroidismo subclínico y que resolvieron el parto por C o por vía V.